微生物を利用した水素生産(バイオ水素生産)は、常温常圧での反応が可能なことから環境負荷が小さく、また、バイオマスを原料としたCO₂循環によるゼロエミッション型のプロセスを構築できる。そのため、将来の持続可能なCO₂フリー水素製造技術の1つと位置づけられている。これまで多様な微生物水素代謝経路が同定され、これらを利用した水素生産に関する多くの研究があるが、生産性が低いことが課題であり、経済性ある水素製造技術は未だ確立していない。このような背景の下、世界各国でバイオ水素生産技術の研究開発が進められている。
バイオ水素生産は、活用する微生物代謝経路の違いにより光エネルギー依存型と非依存型に大別される。前者として、藻類やシアノバクテリアの光合成反応における水の分解、および光合成細菌による有機物の分解(光発酵)に伴う水素生産が挙げられるが、光からのエネルギー変換効率が低く、生産速度が遅いことが課題となる。一方、光エネルギーに依存しない嫌気発酵(暗発酵)による水素生産は有機物を原料とした高速な水素生産が可能だが、有機酸やアルコールといった他の発酵産物の副生が起こるため、原料あたりの水素収率が低いことが課題となる。暗発酵を利用した経済性ある水素製造技術の確立には、遺伝子工学による水素収率の飛躍的な向上が重要な鍵とされている。また、バイオマス由来糖類からの水素収率を高めるため、暗発酵で副生する有機酸を光発酵の基質として利用する統合型水素生産プロセスの研究が行われている。
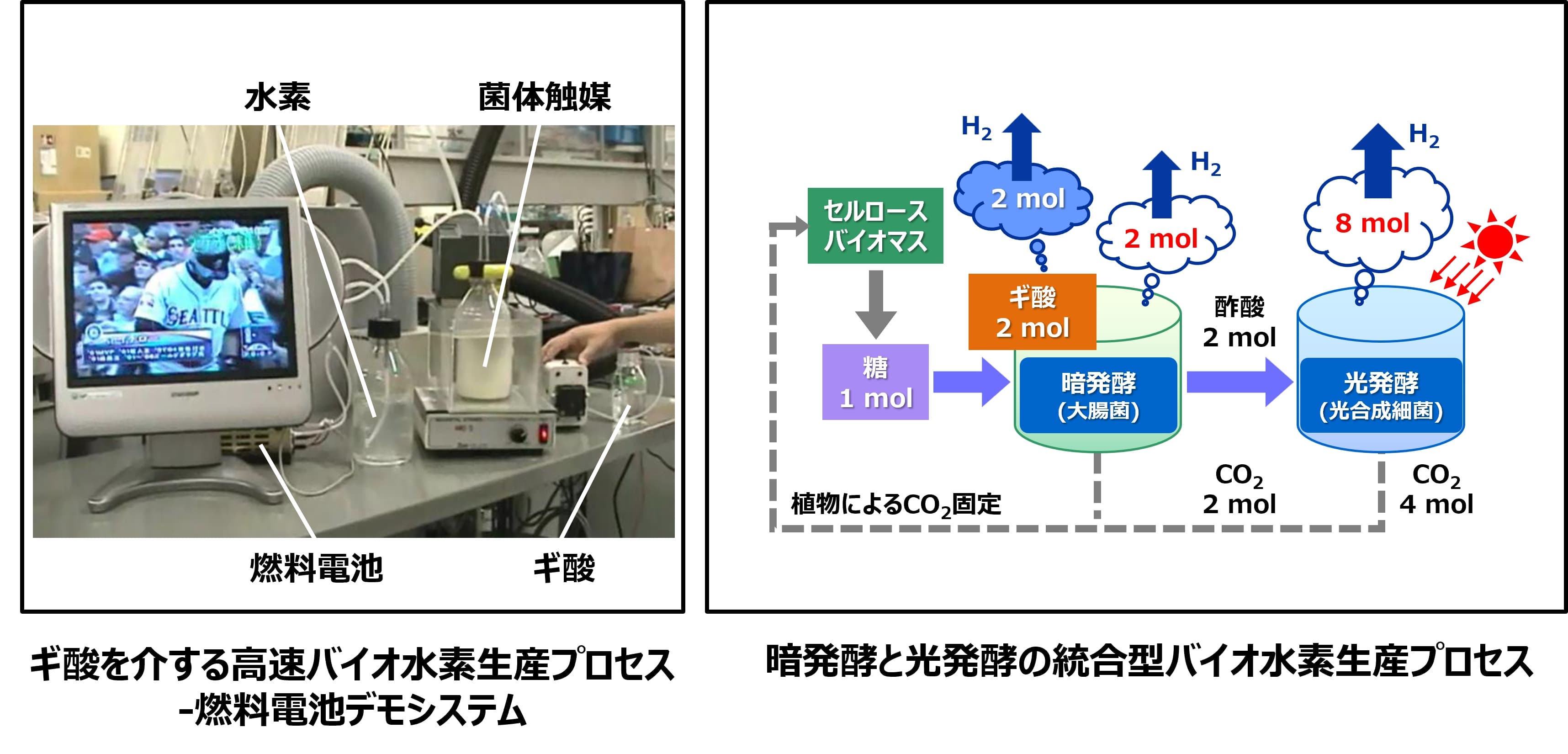
当グループは、シャープ株式会社との共同研究により、ギ酸を介した暗発酵水素生産経路を利用して圧倒的な水素生産速度 (最大300 L H₂/h/L) を達成している。
この高速水素生産プロセスを基盤として、水素収率の向上を目指し、遺伝子工学により異種水素生成酵素(ヒドロゲナーゼ)を導入することで、1モルのグルコースから最大4モルの水素生産が可能な新規水素生産微生物の構築を進めている。また、光発酵との統合によりバイオマス原料(糖)から理論的には最大で12モルの水素生産が可能なプロセスの確立に向けた技術開発に取り組んでおり、光発酵を行う光合成細菌の水素代謝/炭素貯蔵/酢酸代謝の制御機構の改変により恒常的に水素を高生産できる遺伝子組換え株の確立に成功している。
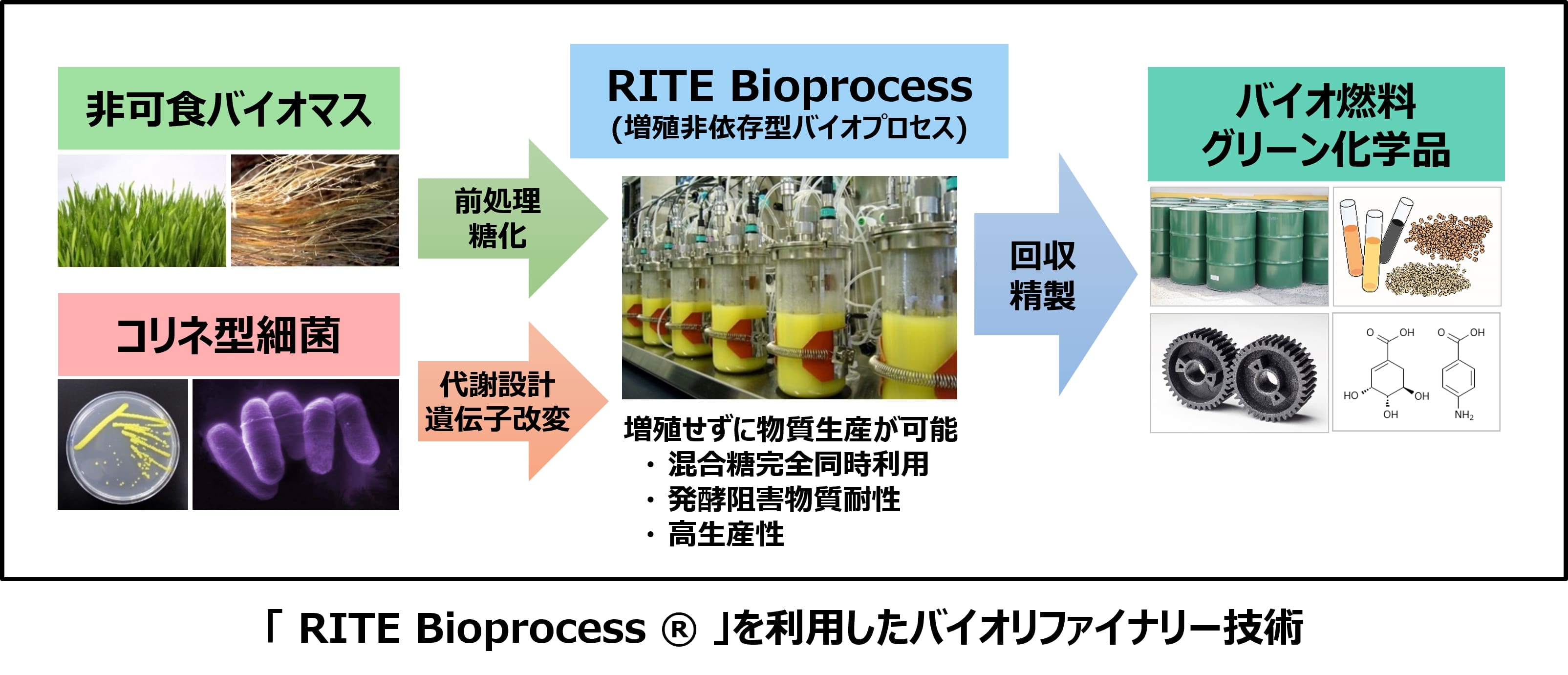
バイオ燃料としてバイオエタノールが先行して商用化されているが、食料資源との競合が課題となっている。そこで、非可食バイオマスの利用が期待されるが、糖化工程において生成するフラン類、フェノール類、有機酸等による発酵(エタノール生産工程)の阻害が課題である。また、生成するC6糖とC5糖の内、代表的なエタノール生産工業微生物である酵母はC5糖を利用できない。発酵阻害物質の除去、代謝工学による工業微生物への発酵阻害物質耐性付与やC6・C5混合糖利用能の付与等について様々な技術開発が進められてきたが、経済性あるプロセスとして確立するためには、バイオマス原料の調達から燃料生産までの全ての工程の一体的な開発が必要と考えられる。
当グループでは、アミノ酸生産に古くから利用されている有用工業微生物であるコリネ型細菌を用いた代謝工学技術の開発と独自の増殖非依存型バイオプロセス(RITE Bioprocess ®)の開発を進めてきた。これらの技術の組み合わせにより、非可食バイオマス由来糖類の高効率利用を可能とし、発酵阻害物質耐性と混合糖同時利用について高い優位性を示す高生産バイオプロセスを確立している。このプロセスを活用して、これまでに、多くの化合物について世界最高レベルの生産性を達成している。現在、バイオ液体燃料では、エタノールやブタノールから高性能バイオジェット燃料素材へ、グリーン化学品では、L-乳酸、D-乳酸、アミノ酸から芳香族化合物などの高機能化学品へと幅広い展開を図っている。また、米国立再生可能エネルギー研究所(NREL)との共同研究により、農産廃棄物(コーンストーバー)由来の混合糖を原料としたバイオエタノール/バイオブタノール生産技術の開発、および、米パシフィック・ノースウエスト国立研究所(PNNL)との共同研究により、ブタノールをジェット燃料などのdrop-in燃料に変換する技術開発を実施してきた。一方、バイオ燃料の事業化に向けた取り組みとしては、日本航空株式会社(JAL)が主催する「10万着で飛ばそう!JALバイオジェット燃料フライト」プロジェクト(2018年~2020年)に当グループのイソブタノール生産技術が採用されている。本プロジェクトは、JALと日本環境設計株式会社が協力して回収した古着を原料とし、バイオジェット燃料を製造するものである。2020年には、このバイオジェット燃料が、純国産として、初めて国際規格であるASTM D7566 Annex5 Neatに合格し、2021年2月4日のJALの羽田-福岡線に、初の国産バイオジェット燃料として使用された。
本研究では、本拠点参画メンバーと連携し、多様な非可食バイオマス原料から一気通貫の液体燃料生産プロセスを構築して、実用化に向けた実証データを取得する。

寺本 陽彦
地球環境産業技術研究機構 バイオ研究グループ
副主席研究員
バイオ水素生産技術開発に関する論文
バイオ液体燃料生産技術開発に関する主要な論文
その他のバイオ変換技術開発に関する主要な論文(バイオ化学品)